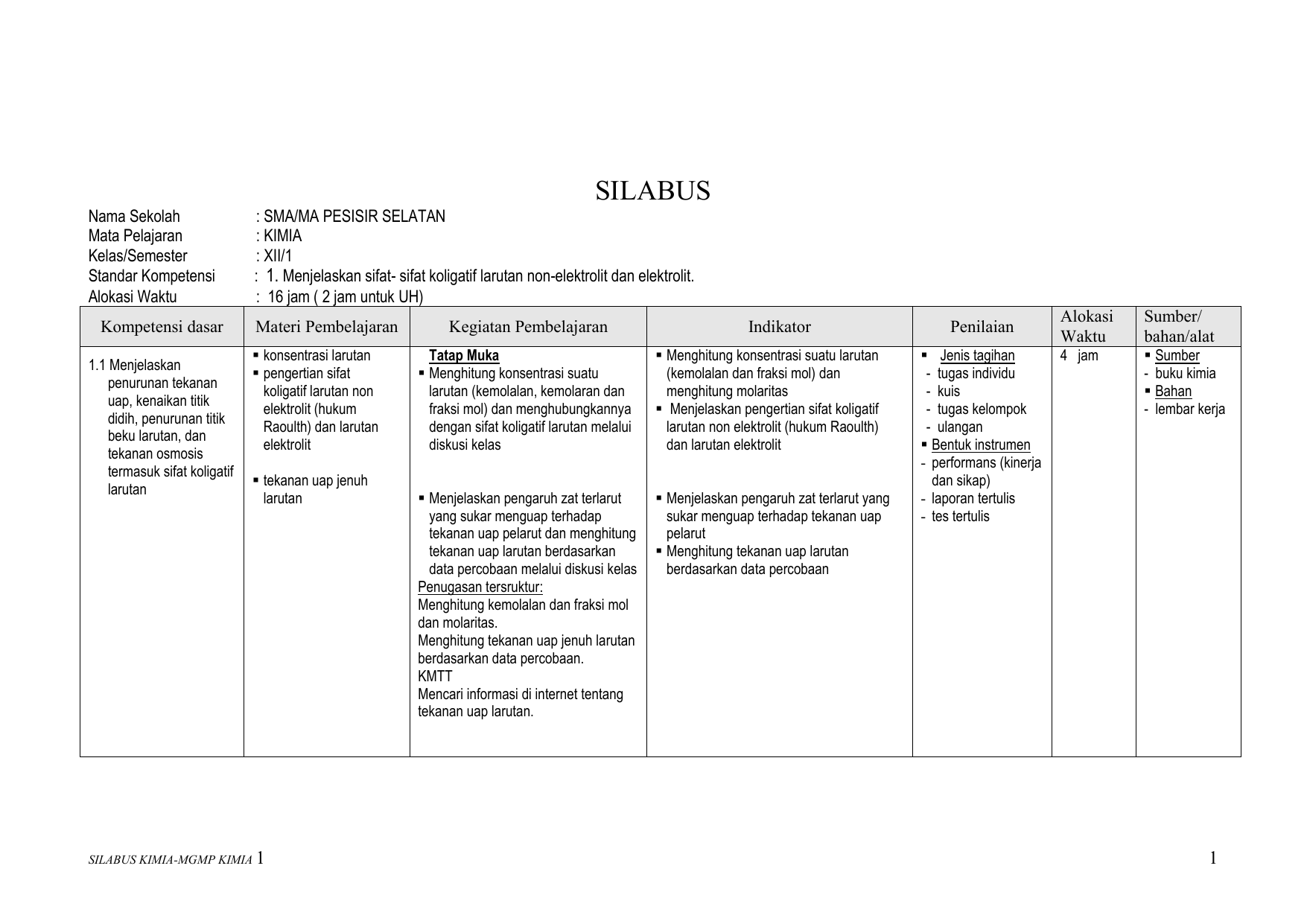
 Artikel Ilmiah Pengembangan Multimedia Crocodille Chemistry
Artikel Ilmiah Pengembangan Multimedia Crocodille Chemistry
Sifat Koligatif Larutan

Sifat Koligatif Larutan – Apa sih Sifat Koligstif Larutan itu? Pada kesempatan kali ini saya akan mengulas tentang Sifat Koligatif Larutan yang meliputi Pengertian, Sifat, Rumus, serta Contoh Soal dan Pembahsan.
Baiklah mari bersama-sama kita simak penjelasan tentang Sifat Koligatif Larutan di bawah ini :
Pengertian
Sifat Koligatif Larutan merupakan Sifat yang tidak mempunyai ketergantungan pada jenis Zat yang terlarut, namun memiliki Sifat bergantung pada banyaknya Partikel Zat yang terlarut di dalam larutan.
Koligatif Larutan memiliki 4 sifat yaitu, Penurunan Tekanan Uap, Peningkatan Titik Didih, Penurunan Titik Beku serta Tekanan Osmotik.
Koligatif Larutan bedakan menjadi dua jenis yaitu, Sifat Larutan Elektrolit dan Non-Elektrolit, dikareanakan Zat yang terlarut di dalam larutan Elektrolit bertambah jumlahnya karena terurai menjadi ion-ion.
Sedangkan Zat yang terlarut dalam larutan Non-Elektrolit jumlahnya akan tetap sebab Zat tersebut tidak terurai menjadi Ion-Ion, maka dapat di simpulkan Sifat Koligatif larutan Non-Elektrolit lebih rendah daripada Larutan Elektrolit.
Molaritas, Molalitas dan Fraksi Mol
Di dalam larutan, memiliki beberapa sifat Zat yang ditetapkan dari banyaknya Partikel-partikel Zat terlarut, oleh sebab itu Sifat Koligatif Larutan hanya ditetapkan dari banyaknya Partikel-partikel Zat terlarut, maka sangat dibutuhkan Konsentrasi larutan untuk mengetahuinya.
Molaritas (M)
Molaritas merupakan besaran yang biasa digunakan dalam menyatakan Konsentrasi atau Kepekatan dari sebuah Larutan. Di dalam hal ini, Molaritas suatu larutan adalah besaran yang menetapkan jumlah Mol Zat yang terlarut di dalam setiap liter larutan tersebut.
Persamaan Molaritas dapat digunakan, dengan bentuk Rumus sebagai berikut ini :
Keterangan :
M = Molaritas
Mr = Massa Molar Zat Terlarut (g/mol)
V = Volume Larutan
Molalitas (m)
Selanjutnya Molalitas atau Kemolalan yaitu jumlah Mol Zat yang terdapat dalam 1 kg (1000 gram) pelarut. Molalitas diartikan dengan persamaan berikut ini :
Keterangan :
m = Molalitas (mol/kg)
Mr = Massa Molar Zat Terlarut (g/mol)
massa = Massa Zat Terlarut (g)
P = Massa Zat Pelarut (g)
Fraksi Mol
Fraksi Mol merupakan satuan Konsentrasi dari semua komponen larutannya berdasarkan Mol. Fraksi mol komponen x , dilambangkan dengan xi, yaitu jumlah Mol komponen i dibagi dengan jumlah Mol dari semua komponen yang ada di dalam larutan.
Fraksi Mol j adalah xj dan seterusnya. Jumlah Fraksi Mol dari semua komponen adalah 1. Persamaan Fraksi Mol dapat menggunakan Rumus dibawah ini :
Sifat Koligatif Larutan Nonelektrolit
Walaupun Sifat Koligatif selalu melibatkan suatu larutan, tetapi sifat Koligatif tidak bergantung pada setiap interaksi antar Molekul Pelarut dan Zat Terlarut.
Namun sifat Koligatif lebih bergatung pada jumlah Zat yang larut di dalam sebuah larutan. Sifat Koligatif tersusun dari Penurunan Tekanan Uap, Peningkatan Titik didih, Penurunan Titi Beku, serta Tekanan Osmotik.
Penurunan Tekanan Uap
Penurunan Tekanan Uap merupakan suatu Penurunan Tekanan Uap pelarut yang disebabkan oleh Zat yang terlarut, pada suhu konstan. Tekanan Uap Larutan adalah tekanan yang disebabkan Uap Jenuh Larutan.
Uap Jenuh Larutan dapat terbentuk di dalam suatu ruangan, jika ruangan tersebut dipenuhi oleh uap air sampai terjadinya keseimbngan antara air dengan uap air.
Di bawah ini merupakan Rumus Persamaan Penurunan Tekanan, yaitu sebagai berikut :
Keterangan :
- P = Tekanan Uap Zat Cair Murni
- P = Tekanan Uap Larutan
Pada tahun 1878, Marie Francois Raoult seorang kimiawan yang berasal dari Perancis melakukan penelitian terhadap tekanan uap jenuh larutan, sehingga Marie menyimpulkan bahwa Tekanan Uap Jenuh larutan sama dengan Fraksi Mol Pelarut yang dikalikan dengan Tekanan Uap Jenuh yang bersifat Pelarut Murni.
Kesimpulan ini biasa disebut dengan Hukum Raoult, persamaan Penurunan Tekanan Uap dapat ditulis :
- P = tekanan uap jenuh larutan
- P = tekanan uap jenuh pelarut murni
- Xp = fraksi mol zat pelarut
- Xt = fraksi mol zat terlarut
Kenaikan Titik Didih
Titik Didih Zat Cair yaitu Suhu tetap suatu Zat Cair yang sudah melalui proses pemanasan sampai Zat cair tersebut mendidih.
Pada suhu ini, tekanan Uap pada Zat Cair sama dengan tekanan udara yang berada di sekitarnya. Hal ini yang menimbulkan terjadinya penguapan di seluruh bagian Zat Cair.
Titik Didih Zat Cair dapat diukur dengan tekanan 1 atmosfer. Dari hasil sebuah percobaan, ternyata titik didih larutan hasilnya selalu lebih tinggi dari titik didih pelarut murninya.
Hal tersebut mungkin terjadi karena adanya Partikel Zat Terlarut dalam suatu larutan yang menghalangi sebuah peristiwa penguapan Partikel Pelarut.
Perbedaan titik didih larutan dengan titik didih pelarut murni di sebut sebagai Kenaikan Titik Didih yang bisa di nyatakan dengan (ΔTb).
Persamaan Kenaikan Titik Didih ini dapat menggunakan Rumus sebagai berikut :
- ΔTb= kenaikan titik didih (oC)
- kb = tetapan kenaikan titik didih molal (oC kg/mol)
- m = molalitas larutan (mol/kg)
- Mr = massa molekul relatif
- P = jumlah massa zat (kg)
Tabel Tetapan Peningkatan Titik Didih (Kb) Beberapa Pelarut
| Pelarut | Titik Didih | Tetapan (Kb) |
| Benzena | 80,1 | 02,53 |
| Karbon Tetraklorida | 76,5 | 04,95 |
| Aseton | 56,2 | 1,71 |
| Naftalena | 217,7 | 05,80 |
| Fenol | 182 | 03,04 |
| Air | 100,0 | 00,52 |
Adanya Zat yang terlarut dalam suatu larutan akan menyebabkan Titik Beku Larutan lebih rendah dibandingkan dengan Titik Beku Pelarutnya. Persamaan dari peristiwa di atas dapat ditulis sebagai berikut :
- ΔTf = penurunan titik beku (oC)
- kf = tetapan perubahan titik beku (oC kg/mol)
- m = molalitas larutan (mol/kg)
- Mr = massa molekul relatif
- P = jumlah massa zat (kg)
Tabel Penurunan Titik Beku (Kf) Beberapa Pelarut
| Pelarut | Titik Beku | Tetapan (Kf) |
| Benzena | 5,45 | 5,12 |
| Karbon Tetraklorida | -23 | 29,8 |
| Aseton | -95,35 | 2,40 |
| Naftalena | 80,5 | 6,94 |
| Fenol | 43 | 7,27 |
| Air | 0 | 1,86 |
Tekanan Osmotik
Tekanan Osmotik merupakan gaya yang sangat diperlukan untuk menyeimbangkan desakan Zat Pelarut yang melalui selaput Semipermiabel ke dalam suatu larutan.
Membran Semipermeabel merupakan sebuah selaput yang bisa dilalui oleh molekul – molekul pelarut tetapi tidak dapat dilalui oleh Zat terlarut.
Menurut Van’t Hoff, Tekanan Osmotik Larutan dapat dirumuskan sebagai berikut :
II = M x R x T
- II = tekanan osmotik
- M = molaritas larutan
- R = tetapan gas (0,082)
- T = suhu mutlak
Sifat Koligatif Larutan Elektrolit
Sifat Koligatif Larutan Elektrolit mempunyai nilai yang lebih besar dibandingkan dengan Sifat Koligatif Larutan Non-Elektrolit.
Dari banyaknya Partikel Zat yang terlarut dari hasil Reaksi Ionisasi, maka dapat simpulkan larutan Elektrolit yang dirumuskan dalam faktor Van’t Hoff yaitu, setiap Perhitungan Sifat Koligatif Larutan Elektrolit selalu dikalikan dengan faktor Van’t Hoff:
i = 1 + (n – 1) α
Keterangan :
= faktor Van’t Hoff
n = jumlah koefisien
= derajat ionisasi
Penurunan Tekanan Uap Jenuh
Penurunan Tekanan Uap Jenuh dengan menggunakan faktor Van’t Hoff dapat di rumuskan sebagai berikut :
Δ P = Po x Xterlarut x i
Kenaikan Titik Didih
Kenaikan Titik Didih dapat di tulis persamaannya sebagai berikut :
ΔTb = kb x m x i
Penurunan Titik Beku
Rumus Persamaannya adalah :
ΔTf = kf x m x i
Tekanan Osmotik
Rumus Persamaannya adalah :
π = M x R x T x i
Contoh Soal
Setelah kita mengetahui apa yang dimaksud dengan Sifat Koligatif Karutan beserta dengan Rumus-Rumusnya, dibawah ini ada beberapa contoh soal, yang bisa kamu pelajari, yaitu sebagai berikut ini :
Soal Pertama
Sebanyak 15 gram glukosa C6 H12 o6 (Mr = 150) dilarutkan kedalam 150 gram air (Mr = 15) pada suhu 28 Celcius, jika tekanan uap air pada suhu tersebut sebesar 31,90 mmHg, maka hitunglah :
a. Tekanan Uap Larutan?
b. Penurunan Tekanan Uap Larutan?
Diketahui:
gr C6 H12 o6
= 15 gr Mr C6 H12 o6
= 150 gr H2o
= 150 gr Mr H2o
= 15
Po = 31,90 mmHg
Pertanyaan :
a. P ….?
b. ΔP ….?
Jawaban :
n C6 H12 o6
= 0,1 mol
n H2o
= 10 mol
Soal Kedua
Diketahui 9,6 gram lilin dilarutkan dalam 40 gr CCl4 pada suhu 25 Celcius, sehingga tekanan uap larutan turun sebesar 0,014 atm. Jika diketahui tekanan uap CCl4 murni pada suhu 25 Celcius = 0,131 atm dan Mr CCl4 = 154.
Berapa jumlah Mr pada sebuah lilin tersebut ?
Diketahui:
gr lilin = 9,6 gr
gr CCl4 = 40 gr; Mr CCl4 = 154
ΔP = 0,014 atm
Po =0,131 atm
T = 25 Celcius
Ditanya : Mr lilin …?
Jawab:
p = Po – ΔP
P = 0,131 atm – 0,014 atm = 0,117 atm
Demikianlah penjelasan mengenai tentang Artikel ini yang meliputi beserta Pengertian, Sifat, Rumus, dan Contoh Soalnya.
Semoga dapat bermanfaat dan menjadi suatu pengetahuan yang berguna untuk kita semua.
Baca Juga Artikel Lainnya :
Gallery Sifat Koligatif Larutan Elektrolit
 Contoh Soal Kenaikan Titik Didih Terupdate
Contoh Soal Kenaikan Titik Didih Terupdate
 Sifat Koligatif Larutan Pengertian Rumus Contoh Soal
Sifat Koligatif Larutan Pengertian Rumus Contoh Soal
 Sifat Koligatif Larutan Nbsp Mendidih Pada Suhu 100 26c
Sifat Koligatif Larutan Nbsp Mendidih Pada Suhu 100 26c
 Definisi Sifat Koligatif Larutan Bisakimia
Definisi Sifat Koligatif Larutan Bisakimia
 Doc Rppkimia Smaberkarakter Xii 1 Sari Monik Academia Edu
Doc Rppkimia Smaberkarakter Xii 1 Sari Monik Academia Edu

 Contoh Soal Sifat Koligatif Larutan Archives Dosen Mipa
Contoh Soal Sifat Koligatif Larutan Archives Dosen Mipa
 Sifat Koligatif Larutan Videos Sifat Koligatif Larutan
Sifat Koligatif Larutan Videos Sifat Koligatif Larutan
 Sifat Koligatif Larutan Hamela Sari
Sifat Koligatif Larutan Hamela Sari
Github Suryaaws Sifatkoligatifelektrolit Perhitungan
 Doc Sifat Koligatif Larutan Tris Naldi Academia Edu
Doc Sifat Koligatif Larutan Tris Naldi Academia Edu
 Ppt Pembelajaran Kimia Kelas Xii Semester 1 Powerpoint
Ppt Pembelajaran Kimia Kelas Xii Semester 1 Powerpoint
 Soal Essay Tentang Sifat Koligatif Larutan Non Elektrolit
Soal Essay Tentang Sifat Koligatif Larutan Non Elektrolit
 Sifat Koligatif Larutan Pengertian Sifat Dan Contoh Soal
Sifat Koligatif Larutan Pengertian Sifat Dan Contoh Soal
 Sifat Sifat Koligatif Larutan Ppt Download
Sifat Sifat Koligatif Larutan Ppt Download
 Sifat Koligatif Larutan Pengertian Contoh Dan
Sifat Koligatif Larutan Pengertian Contoh Dan
 1 Sifat Koligatif Larutan Tujuan Pembelajaran
1 Sifat Koligatif Larutan Tujuan Pembelajaran
 Web Viewmenjelaskan Sifat Sifat Koligatif Larutan Elektrolit
Web Viewmenjelaskan Sifat Sifat Koligatif Larutan Elektrolit
Bab 16 Sifat Koligatif Larutan Dewita Triani Putri
 Sifat Koligatif Larutan Elektrolit Dan Non Elektrolit
Sifat Koligatif Larutan Elektrolit Dan Non Elektrolit
 Sifat Koligatif Larutan Elektrolit
Sifat Koligatif Larutan Elektrolit
 Contoh Soal Sifat Koligatif Larutan Elektrolit Mastah
Contoh Soal Sifat Koligatif Larutan Elektrolit Mastah
 Sifat Koligatif Larutan Pdf Free Download
Sifat Koligatif Larutan Pdf Free Download
 Sifat Koligatif Larutan Pengertian Contoh Dan
Sifat Koligatif Larutan Pengertian Contoh Dan
 Sifat Koligatif Larutan Ega Yoza
Sifat Koligatif Larutan Ega Yoza
 Artikel Ilmiah Pengembangan Multimedia Crocodille Chemistry
Artikel Ilmiah Pengembangan Multimedia Crocodille Chemistry


Comments
Post a Comment